Von Mario Martin
Arzneimittel unterliegen in Deutschland verschieden Regularien, die Hersteller zu bestimmten Praktiken verpflichten. Die Vorschriften sind in folgenden Gesetzen und Verordnungen geregelt: Gesetze und Verordnungen des Arzneimittelgesetzes (AMG), des Transfusionsgesetzes (TFG) und der Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV).
Im Zuge der nahenden Zulassung der Impfstoffe gegen das Coronavirus hatte der Gesetzgeber am 25. Mai 2020 die Medizinischer Bedarf Versorgungssicherungsstellungsverordnung (MedBVSV) erlassen.
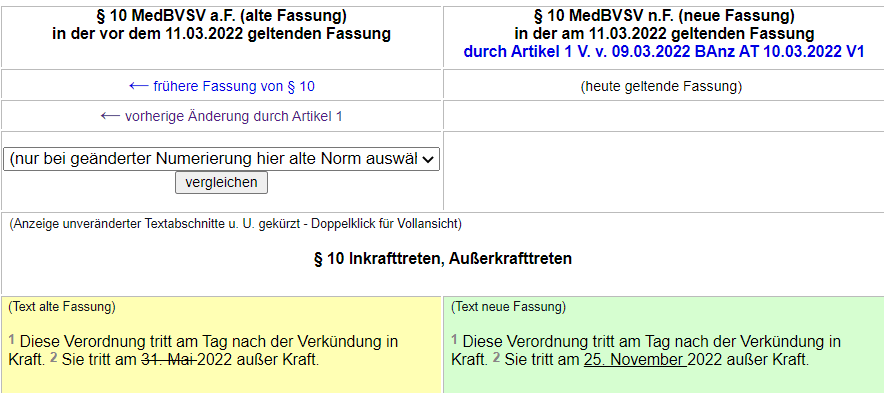
Die brisante Verordnung wurde kaum in der Öffentlichkeit diskutiert. Nur vereinzelte Meldungen, wie hier von der Pharmazeutischen Zeitung, sind auffindbar. Und auch die am 9. März durch das Bundesministerium für Gesundheit über den Bundesanzeiger bekannt gemachte Verlängerung der Verordnung fand keine Beachtung in den Medien.
Am 10. März trat eine Neufassung der Verordnung in Kraft, wonach die Gültigkeit bis in den November verlängert wird.
Die Verordnung setzt wesentliche Punkte der eingangs erwähnten Bestimmungen außer Kraft. In § 3 MedBVSV ist festgelegt, welche Ausnahmen im Hinblick auf die Einführung der Impfstoffe gelten sollen.
Außer Kraft gesetzt werden:
§ 8 Abs. 3 AMG (Verbot des Inverkehrbringen abgelaufener Arzneimittel): Abgelaufene COVID-19-Impfstoffe dürfen nach wie vor verabreicht werden und sind auch im Verkehr.
§ 10 AMG (Kennzeichnungspflicht für Arzneimittel): Für COVID-19-Impfstoffe entfällt die Kennzeichnungspflicht.
§ 11 AMG (Packungsbeilage): Die Pflicht zum Beifügen einer Packungsbeilage entfällt für die COVID-19-Impfstoffe.
§ 11a AMG (Fachinformation): Den Impfstoffen müssen keine Fachinformationen beigelegt werden.
§ 21 AMG (Zulassungspflicht): Eine Zulassung für die COVID-19-Impfstoffe ist nicht nötig.
§ 32 AMG (Staatliche Chargenprüfung): Eine staatliche Prüfung der Chargen ist für die Impfstoffe nicht erforderlich.
Vertrieb und Herstellung im AMG
§ 43 AMG (Apothekenpflicht): Apotheken dürfen umgangen werden.
§ 47 AMG (Vertriebswege): Der gängige Vertriebsweg Großhandel, Apotheke, Arzt, Patient entfällt für die Verteilung der COVID-19-Impfstoffe.
Diverse andere Paragrafen des AMG, die den Handel mit den Impfstoffen regeln, entfallen ebenfalls, wie die Zertifikatpflicht für den Import, Einfuhrerlaubnis für Gewebe, Exportbestimmungen, Preisbeschränkungen.
Es entfallen außerdem § 4a Absatz 1 (Abgabe nur durch berechtigte Betriebe) und § 6 AM-HandelsV (Auslieferung nur an Betriebe mit Erlaubnis), womit die Impfstoffe an jeden ausgeliefert und von jedem abgegeben werden dürfen.
Weiterhin entfallen § 84 AMG (Gefährdungshaftung) und § 94 AMG (Deckungsvorsorge), womit Ärzte, Apotheker und Hersteller für Verabreichungen und Folgen der Impfstoffe aus der Haftung genommen werden, wenn der Impfstoff durch das Bundesministerium „als Reaktion auf die vermutete oder bestätigte Verbreitung des SARS-CoV-2-Erregers in den Verkehr gebracht werden und nach den Gegebenheiten des Einzelfalls die auf Absatz 1 gestützten Abweichungen vom Arzneimittelgesetz geeignet sind, den Schaden zu verursachen“.
§ 4 MedBVSV hebt die folgenden Vorschriften des AMG auf:
§ 13 AMG (Herstellungserlaubnis): Es reicht die Zustimmung der Behörde, um die Herstellungserlaubnis durch jedermann zu umgehen.
§ 15 AMG (Sachkenntnis): Die Erlaubnis der Behörde erlaubt die Herstellung ohne Sachkenntnis durch jedermann.
§ 19 AMG (Verantwortungsbereiche): Die Zustimmung der Behörden ist ausreichend. Eine sachkundige Person für die Herstellung ist nicht notwendig (fast analog zu § 15 AMG).
Qualitätssicherung durch das AMWHV
Die Arzneimittel- und Wirkstoffherstellungsverordnung (AMWHV) regelt die Qualitätssicherung im Herstellungsprozess von Arzneimitteln. Es gelten normalerweise Qualitätsmanagementsystem (QMS), Gute Herstellungspraxis (GMP) und Gute fachliche Praxis (GfP).
Die Aufhebung dieser Vorschriften steht in engem Zusammenhang mit dem Fragenkatalog, den eine Reihe von Chemieprofessoren an das Paul-Ehrlich-Institut und Biontech richteten, um Unklarheiten hinsichtlich der fehlenden Qualitätssicherung im Herstellungsprozess zu beseitigen. Noch immer sind die Fragen der Wissenschaftler nicht zufriedenstellend beantwortet.
Da die Vorschriften des AMWHV viel zu streng sind, um die Zirkulation der Impfstoffe zu ermöglichen, wurden also auch die folgende Regelungen durch § 4 MedBVSV ausgesetzt:
§ 3 AMWHV (QMS, GMP, GfP): Die Zustimmung der Behörde ist ausreichend. Die COVID-19-Impfstoffe können auch entgegen der QMS, GMP und GfP hergestellt werden.
§ 4 AMWHV (Personal): Fordert erneut die Anwesenheit sachkundigen und qualifizierten Personals bei der Herstellung. Die Vorschrift entfällt durch die Zustimmung der Behörde.
§ 11 AMWHV (Selbstinspektion und Lieferantenqualifizierung): Durch Zustimmung der Behörde entfallen die regelmäßige Selbstinspektion der Hersteller und die Lieferantenqualifizierung.
Die folgenden Regelungen entfallen durch die Zustimmung der jeweiligen Behörde:
§ 15 AMWHV (Kennzeichnung), § 16 AMWHV (Freigabe), § 17 AMWHV (Inverkehrbringen und Einfuhr), § 22 – 26 AMWHV (Herstellung, Prüfung, Kennzeichnung, Freigabe und Inverkehrbringen, Inverkehrbringen und Einfuhr).
Aufhebung des Transfusionsgesetzes
§ 5 der MedBVSV erlaubt die Verstümmelung des Transfusionsgesetzes (TFG). Das Gesetz regelt die Gewinnung von Blut, Blutbestandteilen und Blutprodukten sowie deren Anwendung am Menschen bei Bluttransfusionen und die damit einhergehenden Dokumentationspflichten.
§ 4 und § 7 TFG (Anforderung an die Spendeneinrichtung / Anforderungen zur Entnahme der Spende): Geimpfte Personen dürfen Blut spenden, obwohl inzwischen klar ist, dass die toxischen Spike-Proteine noch Monate nach der Impfung überall im Körper nachgewiesen werden können.
§ 5 Absatz 1 Satz 2 TFG (Auswahl der spendenden Personen): Blutspender müssen nicht mehr nach der Verantwortung einer ärztlichen Person nach dem Stand der medizinischen Wissenschaft und Technik für tauglich befunden worden sein.
Durch die Umgehung der Vorschriften des Transfusionsgesetzes werden also auch nicht geimpfte Dritte den toxischen Spike-Proteinen ausgesetzt, wenn sie im Notfall eine Bluttransfusion in Anspruch nehmen müssen.
Verordnung auch ohne Notlage weiter in Kraft
Nochmal sei daran erinnert, dass all diese Vorschriften bereits getroffen wurden, bevor die ersten manipulierten Zulassungsstudien der Impfstoffe veröffentlicht wurden.
Die Aussetzung von Gesetzen und Verordnungen, die sich über viele Jahre zum Vorteil der Menschen bewährt hatten, hätte schon Anfang 2020 von den Verwaltungsgerichten kassiert werden müssen. Jedoch hätte man damals zumindest noch die konstruierte “epidemische Lage von nationaler Tragweite” für real halten können, die Bedingung für die Verordnung wurde.
Auch diese Bedingung wurde zum 11. März geändert. Die Notlage braucht es nicht mehr, um einen rechtsfreien Raum für alle beteiligten Akteure an der Verbreitung und Verabreichung der COVID-19-Impfstoffe zu erzeugen.

Die Verordnung ist die Conditio sine qua non für die fortlaufende Impfkampagne. Daher ist damit zu rechnen, dass sie noch vor dem 25. November erneut verlängert wird, da sonst die Regelungen des AMG, TFG und der AMWHV wieder greifen, was zur nächsten Welle der „Pandemie“ führen würde: Einer Klagewelle.
Die Verordnung verhindert den Dammbruch.

Namentlich gekennzeichnete Beiträge geben immer die Meinung des Autors wieder, nicht meine. Ich schätze meine Leser als erwachsene Menschen und will ihnen unterschiedliche Blickwinkel bieten, damit sie sich selbst eine Meinung bilden können.
Mario Martin ist Ökonom und arbeitet als Software-Projektmanager in Berlin.
Bild: nitpicker / ShutterstockText: mm
mehr von Mario Martin auf reitschuster.de